التفكك الإشعاعي
يعبر النشاط الإشعاعي عن التحول النووي التلقائي spontaneous nuclear transformation الذي تتحول بموجبه النوى المثارة excited nuclei إلى نوى أكثر استقراراً، وذلك بإصدار emission جسيمات طاقية energetic particles أو إشعاع كهرطيسي أو كليهما.
استقرار النواة
يرتبط النشاط الإشعاعي للنواة بسوية استقرار هذه النواة. لا تقوم النواة المستقرة stable nucleus بأي تحول داخلي تلقائي، وهذا ما يميز كافة المواد غير المشعة.
تملك النوى المشعة ما يكفي من الاستقرار لمقاومة التحول لفترة من الزمن، تقوم بعدها بتحول تلقائي تصدر فيه كمية من الطاقة، وتنتقل النواة نتيجة لهذا التحول إلى نواة مشعة أخرى، أو قد تصل إلى وضع مستقر.
الكثير من الخلائط النووية nuclear mixtures (مزيج بروتونات ـ نترونات) غير مستقر أبداً ولا يستطيع الاستمرار كنواة. فقط حوالي 1300 مزيج نووي من بروتونات ونترونات يملك ما يكفي من الاستقرار ليدعى مستقر أو مشع.
من الواضح أن العامل الأهم في تحديد استقرار النواة هو نسبة النترونات إلى البروتونات. بالنسبة للنوى الأصغر، نلاحظ أن نسبة 1:1 (نترونات : بروتونات) تميز الحالة الأكثر استقراراً، إلا أن النسبة التي تميز الاستقرار النووي تزداد بشكل متدرج مع ازدياد العدد الذري لتصل إلى 1:1.6 للنوى الكبيرة.
عندما تكون نسبة النترونات إلى البروتونات قريبة (أصغر أو أكبر بقليل) من النسبة التي تميز الاستقرار النووي، فإنها تشير عموماً إلى نوى مشعة، أما عندما تكون النسبة مختلفة بشكل ملحوظ عن النسبة المستقرة، فإنها تشير إلى خلائط نووية غير مستقرة وغير موجودة في الطبيعة.
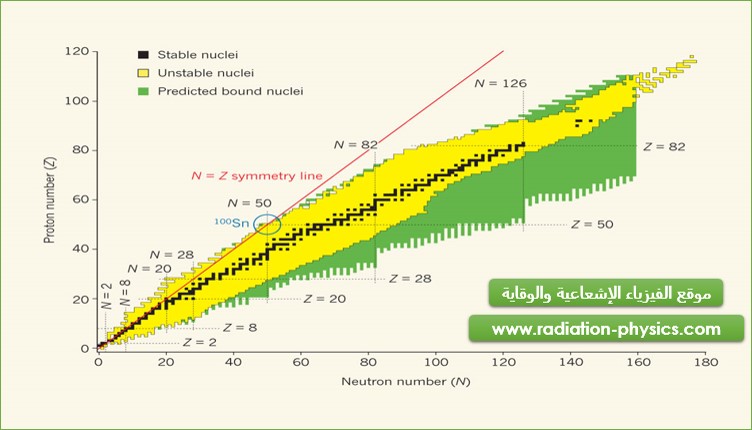
الشكل (1): العلاقة بين استقرار النواة ونسبة النترونات إلى البروتونات.
خريطة النكليدات
يمثل الشكل (1) صورة مصغرة لما يدعى خريطة النكليدات Chart of the Nuclides. ترتب خريطة النكليدات كافة النكليدات وفق أعداد البروتونات والنترونات في النواة. يمثل المحور الأفقي عدد النترونات والمحور العمودي عدد البروتونات. ويؤدي ذلك إلى إدراج كافة نظائر عنصر ما كحزمة أفقية في خريطة النكليدات.
أنماط التفكك الإشعاعي
يصنف النشاط الإشعاعي وفقاً للأنماط modes التالية:
تفكك ألفا
تقوم النواة المشعة في تفكك ألفا (α) بإصدار نواة الهليوم التي تتألف من بروتونين ونترونين وفق المخطط الهيكلي التالي:
(Z, A) → (Z-2, A-4) + 4He
مثال على ذلك تفكك الراديوم معطياً الرادون:
226Ra → 222Rn + 4He
يؤدي تفكك ألفا إلى تحرير طاقة، حيث يظهر القياس أن مجموع كتلتي النواة النتاج progeny nucleus وجسيم ألفا أقل من كتلة النواة الأصل parent nucleus. تفسر علاقة أينشتاين Einstein الشهيرة E = m.c2، والدالة على تكافئ الكتلة m والطاقة E، هذا الضياع في الكتلة على أنه قد تحول إلى طاقة حركية kinetic energy تحملها نواتج التفكك decay products. يحمل جسيم ألفا الطاقة الناتجة عن تفكك ألفا وهي محددة بدقة وتميز النكليد المتفكك وتتراوح قيمها بين 4 MeV و8 MeV.
ينخفض العدد الذري Z بمقدار اثنين نظراً لخسارة بروتونين عند إصدار النكليد المشع لجسيم ألفا، وتنخفض الكتلة الذرية بمقدار أربعة نظراً لخسارة بروتونين ونترونين.
تفكك بيتا
تقوم النواة المشعة في تفكك بيتا (β) بخفض الفائض excess النتروني في النواة وذلك بتحويل نترون إلى بروتون مصدرة إلكترون:
n → p + e- + نترينو مضاد (β-) تفكك بيتا السالب
أو بخفض الفائض البروتوني بتحويل بروتون إلى نترون مصدرة بوزترون:
p → n + e+ + نترينو (β+) تفكك بيتا الموجب
كما يمكن أن تقوم النواة بتخفيض الفائض البروتوني بالتقاط أحد الإلكترونات الذرية electron capture المحيطة بها:
p + e- → n + نترينو (ε) التقاط الإلكترون
في هذه التفككات يتغير كل من Z و N بمقدار ±1، مع بقاء العدد الكتلي A ثابتاً. من الأمثلة على هذه التفككات:
131I → 131Xe + e- + نترينو مضاد
25Al → 25Mg + e+ + نترينو
54Mn + e- → 54Cr + نترينو
كما يمكن أن يحدث تفكك β بشكل مضاعف double beta decay أي:
2n → 2p + 2e- + 2 نترينو مضاد المضاعف β تفكك
ويحدث هذا التفكك عندما يكون تفكك α محظوراً أو غير مفضل من حيث الطاقة. مثال على ذلك التفكك:
48Ca → 48Ti + 2e- + 2 نترينو مضاد
حيث التفكك المضاعف مفضل من حيث الطاقة على تفكك β إلى 48Sc.
تظهر خريطة النكليدات مناطق تفكك بيتا، الشكل (1). تتميز مناطق تفكك بيتا السالب بالتفوق النتروني، بينما تتميز مناطق تفكك بيتا الموجب والتقاط الإلكترون بالتفوق البروتوني مقارنة بالنوى المستقرة.
النترينو والنترينو المضاد
يرافق تفكك بيتا الموجب والتقاط الإلكترون إصدار جسيم يدعى نترينو Neutrino. أما تفكك بيتا السالب فيترافق بإصدار نترينو مضاد Antineutrino. يحمل النترينو أو النترينو المضاد جزءاً من الطاقة الناتجة عن التفكك. لا يحمل النترينو أو النترينو المضاد شحنة كهربائية، وهما عديمي (أو ضئيلي؟) الكتلة، ولكنهما يحملان طاقة واندفاع momentum.
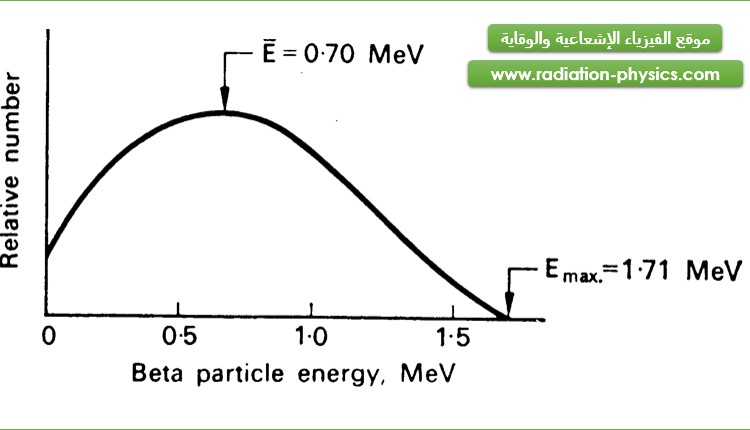
يؤدي تقاسم الطاقة الناتجة عن تفكك بيتا بين الإلكترون والنترينو المضاد إلى صدور جسيمات بيتا بتوزع طاقي يرتبط حده الأقصى بالنكليد المتفكك. يظهر الشكل (2) التوزع الطاقي لجسيمات بيتا الصادرة عن الفسفور 32.
فناء البوزترون
البوزترون هو الجسيم المضاد للإلكترون. يؤدي توفر الإلكترونات في محيط النواة التي تقوم بتفكك بيتا الموجب إلى فناء البوزترون positron annihilation الناتج عن هذا التفكك مع أحد هذه الإلكترونات. وينتج عن فناء البوزترون إصدار شعاعي غاما باتجاهين متعاكسين ولكل منهما طاقة محددة مقدارها 511 keV، أي ما يعادل كتلة أي من الإلكترون أو البوزترون. تتحول إذاً كامل كتلتي الإلكترون والبوزترون إلى طاقة يحملها شعاعا غاما الناتجان.
مفعول أوجيه
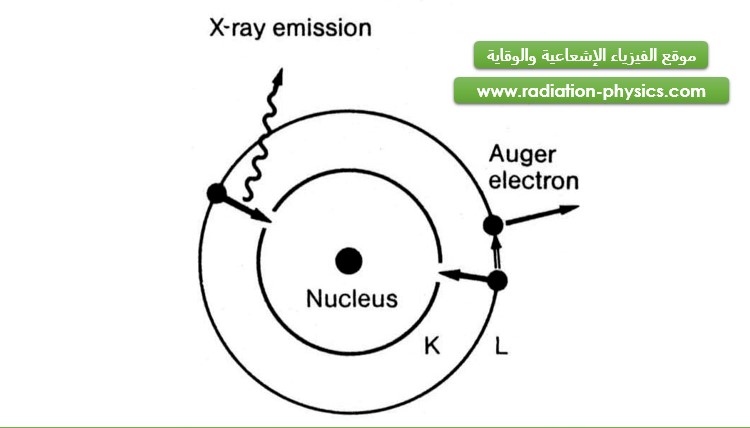
يتم التقاط الإلكترون في التفكك ε عادة من الطبقة الإلكترونية الأقرب إلى النواة وهي الطبقة K، مما يؤدي إلى حدوث فراغ في هذه الطبقة، وهذا ما يؤدي عادة إلى إصدار أشعة سينية، إلا أنه يمكن للإلكترون المنتقل من الطبقة الأعلى إلى الطبقة K أن يعطي الفرق في الطاقة بين السويتين إلى إلكترون آخر يستخدم هذه الطاقة لمغادرة الذرة، وهذا ما يدعى بمفعول أوجيه Auger Effect أو المفعول الضوئي الداخلي inner photoeffect. يوضح الشكل (3) مفعول أوجيه، مظهراً تنافس هذا المفعول مع إصدار الأشعة السينية، ويدعى الإلكترون الصادر عن الذرة في هذا المفعول بإلكترون أوجيه.
تفكك غاما
تنتقل النواة المثارة في تفكك غاما (γ) إلى سوية نووية أكثر استقراراً مصدرة الفرق في الطاقة بين السويتين كإشعاع كهرطيسي وفق المخطط الهيكلي:
(Z,A)* → (Z,A) + γ
وعادة ما يلي ذلك تفكك ألفا أو بيتا. لا يترافق تفكك غاما بتغير في العدد الذري أو الكتلة الذرية، كونه إصدار طاقة دون جسيمات. تصدر أشعة غاما عن النواة بطاقات محددة تصل إلى بضعة ميغا إلكترون فولط (MeV). تميز الطاقات الصادرة النكليد المشع الذي قام بإصدارها ويمكن استخدامها في تحديد هذا النكليد.
الانتقالات الأيزوميرية
يمتاز تفكك غاما عادة بالسرعة، إذ يبلغ العمر النصف لهذا التفكك عادة أقل من 10-9 s. في بعض الحالات يكون زمن التفكك طويل نسبياً، وقد يصل عمر النصف في هذه الحالات إلى ساعات أو أيام. تعرف هذه الانتقالات بالانتقالات الأيزوميرية isomeric transition، وتدعى السوية المثارة للنواة في هذه الحالة بالسوية الأيزوميرية أو بالأيزومير، ويرمز لهذه السوية عادة بمؤشر علوي m مثل 99mTc ، بينما يرمز للسوية المستقرة بمؤشر علوي g مثل 99gTc:
99mTc → 99gTc + γ (141 keV) T1/2 = 6.0 h
الانقلاب الداخلي
في بعض الحالات تؤدي الطاقة الناتجة عن الانتقال الأيزوميري إلى طرد أحد الإلكترونات الذرية خارج الذرة، وتدعى هذه الظاهرة بالانقلاب الداخلي internal conversion IC وتشكل بديلاً لإصدار غاما، كما يؤدي حدوث شاغر نتيجة طرد أحد الإلكترونات الذرية إلى إصدار أشعة سينية أو إلكترون أوجيه. مثال على الانقلاب الداخلي:
99mTc → 99gTc + IC e- (119 keV)
بالطبع عمر النصف للانقلاب الداخلي مطابق لعمر النصف للتفكك الأيزوميري المقابل. هذا التفكك مختلف تماماً عن تفكك بيتا، إذ لايحدث أي تغير في N أو Z، ولكن يتم تأيين الذرة.
إصدار النترون
لا يرتبط إصدار النترون عادة بالتفكك الإشعاعي، لكن بعض نواتج المفاعلات النووية تقوم بإصدار النترونات. يرتبط إصدار النترون إذاً بالإنتاج الصنعي artificial production للمصادر النترونية في المفاعلات النووية أو مصادر النترون المصنعة manufactured neutron sources.
المصدر الأكبر للنترونات هو المفاعل النووي حيث تنتج النترونات عن انشطار النوى الثقيلة كاليورانيوم والبلوتونيوم. تنتج مصادر النترون الأخرى عن التفاعلات النووية التي يسببها اصطدام جسيم مشحون عالي الطاقة بنواة الدريئة target. يظهر ذلك في المسرعات accelerators ومصادر النترون المغلفة encapsulated neutron sources كتلك المستخدمة في العيارات الصناعية industrial gauges. يتم مزج بودرة من أحد مصادر ألفا كالأمريشيوم 241 ببودرة من البيريليوم في المصدر المغلف. تنتج النترونات عن قذف نواة البيريليوم بجسيمات ألفا عالية الطاقة الصادرة عن الأمريشيوم.
يؤدي إصدار النترون إلى خفض عدد الكتلة الذرية للنكليد المشع A بمقدار واحد لوجود نترون أقل في النواة. يصدر النترون بطاقة محددة تميز النكليد المشع الذي قام بإصداره.
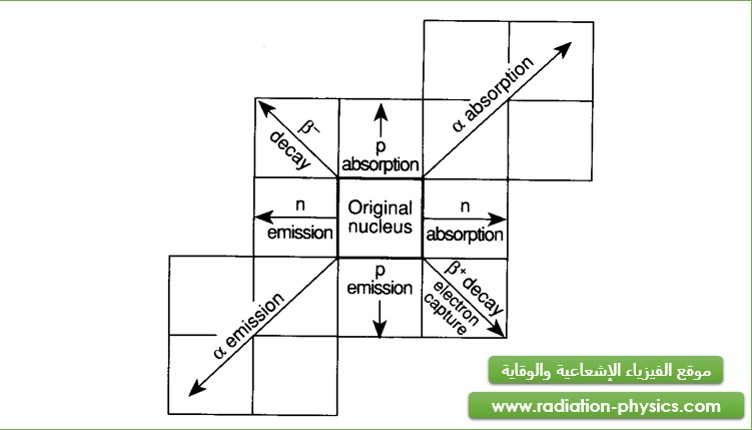
ختاماً يلخص الشكل (4) الانزياحات الناتجة عن التفكك الإشعاعي في خريطة النكليدات.
يتناسب احتمال تفكك decay probability نواة مشعة في زمن قدره dt خطياً مع هذا الزمن:
P(dt) ~ dt
وذلك في حال كان هذا الزمن صغيراً بحيث P(dt) << 1، ويدعى ثابت التناسب بثابت التفكك λ decay constant، أي:
P(dt) = λ dt
لحساب احتمال استمرار النواة المشعة بعد انقضاء زمن قدره t نقسم هذا الزمن إلى n مقطع زمني متساوي بطول dt = t / n يحقق الشرط P(dt) << 1. احتمال استمرار النواة بعد مرور المقطع الزمني الأول:
1 – P(dt)
واحتمال استمرارها بعد مرور المقطع الزمني الثاني:
[ 1 – P(dt) ]2
وبعد n مقطع زمني:
[ 1 – P(dt) ]n = ( 1 – λ dt )n = ( 1 – λ t / n )n → e-λt
وذلك عندما ينتهي ∞ → n أي dt → 0. إذا كان لدينا عند بدء قياس الزمن عدد N0 من النوى المشعة المتطابقة، فإن عدد النوى المشعة الأكثر احتمالاً بعد مضي زمن قدره t هو:
N(t) = N0 e-λt (1)
وتدعى هذه العلاقة بقانون التفكك الإشعاعي law of radioactive decay.
عمر النصف T1/2 half-life للتفكك الإشعاعي هو الفترة الزمنية التي ينخفض فيها عدد النوى المشعة إلى النصف أي:
N(T1/2) = N0 / 2 = N0 Exp.(-λ T1/2)
وبالتالي نحصل على العلاقة بين ثابت التفكك وعمر النصف:
Exp.(λ T1/2) = 2 ⇒ λ T1/2 = ln 2 ⇒
T1/2 = ln 2 / λ = 0.693 / λ (2)
يعرف العمر الوسطي τ mean life للنواة المشعة بأنه الفترة الزمنية الوسطية التي يستغرقها تفكك هذه النواة. يبلغ عدد النوى التي تتفكك في الفترة الزمنية من t إلى t + dt:
dN = - P(dt) N(t) = - λ N(t) dt
حيث ترمز الإشارة السالبة إلى تناقص عدد النوى المشعة مع الزمن. وبالتالي يمكن حساب العمر الوسطي للنواة المشعة بأخذ تكامل فترات استمرار النوى المشعة، وتقسيمها على العدد الإجمالي لهذه النوى:
τ = ( ∫ t dN ) ∕ ( ∫ dN )
لنحصل على:
τ = 1 / λ (3)
أي أن العمر الوسطي للنواة يساوي مقلوب ثابت التفكك، وبعد مضي هذه الفترة يتبقى من المادة المشعة % ![]() من القيمة الأصلية، وذلك حسب العلاقة (1).
من القيمة الأصلية، وذلك حسب العلاقة (1).
المرجع: محاضرات د. سامي حداد في الفيزياء النووية - جامعة دمشق
تحرير: سامر عبد الرزاق بكر
شكرااااا جداااا جداااااااا