البُنية الذَّرية
تقسم الذرة إلى منطقتين أساسيتين: النواة والإلكترونات الذرية. توجد النواة في مركز الذرة، وهي صغيرة جداً بالمقارنة مع الذرة، فقطرها أصغر من ![]() ، بينما يصل قطر الذرة إلى حوالي
، بينما يصل قطر الذرة إلى حوالي ![]() ، أي أن النواة تحتل أقل من جزء من مليار من حجم الذرة. إلا أن النواة تضم قرابة مجمل كتلة الذرة. وتحيط بالنواة سحابة مكونة من عدد
، أي أن النواة تحتل أقل من جزء من مليار من حجم الذرة. إلا أن النواة تضم قرابة مجمل كتلة الذرة. وتحيط بالنواة سحابة مكونة من عدد ![]() من الإلكترونات تشغل الحجم الذري.
من الإلكترونات تشغل الحجم الذري.
نظراً لحجم الذرة الصغير، فإنه ليس من المريح قياس كتلة الذرة ومكوناتها بالواحدات الاعتيادية كالكيلو غرام. واحدة قياس الكتل المستخدمة هي واحدة الكتل الذرية:
![]() atomic mass unit، والمعرفة على أنها
atomic mass unit، والمعرفة على أنها ![]() من الكتلة الذرية لذرة الكربون
من الكتلة الذرية لذرة الكربون ![]() .
.
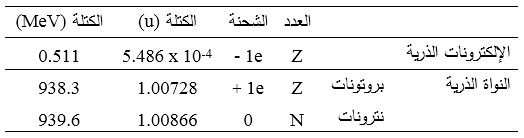
الفرق في الكتلة بين النترون والبروتون صغير نسبياً ويبلغ حوالي واحد بالألف، إذ تبلغ كتلة النترون ![]()
![]() والبروتون
والبروتون ![]()
![]() ، أما كتلة الإلكترون فهي مهملة نسبياً مقابل هاتين الكتلتين إذ تبلغ
، أما كتلة الإلكترون فهي مهملة نسبياً مقابل هاتين الكتلتين إذ تبلغ ![]() ولذلك تضم النواة قرابة مجمل كتلة الذرة.
ولذلك تضم النواة قرابة مجمل كتلة الذرة.
كما يتم استخدام واحدة الطاقة ميغا إلكترون فولط ![]() في قياس كتلة الإلكترون والنواة ومكوناتها، إذ تدل علاقة أينشتاين Einstein الشهيرة،
في قياس كتلة الإلكترون والنواة ومكوناتها، إذ تدل علاقة أينشتاين Einstein الشهيرة، ![]() ، على تكافئ الكتلة
، على تكافئ الكتلة ![]() والطاقة
والطاقة ![]() . الإلكترون فولط eV هو الطاقة التي يحصل عليها الإلكترون عند تسريعه في فولطية voltage قدرها فولط واحد، ويكافئ بالجول
. الإلكترون فولط eV هو الطاقة التي يحصل عليها الإلكترون عند تسريعه في فولطية voltage قدرها فولط واحد، ويكافئ بالجول ![]() ، أي:
، أي:
![]()
باستخدام علاقة أينشتاين يتبين أن واحدة الكتل الذرية تعادل
![]()
وتعادل كتلة النترون ![]()
![]() والبروتون
والبروتون ![]()
![]() أما كتلة الإلكترون فتعادل
أما كتلة الإلكترون فتعادل ![]()
![]() .
.
- العدد الذري، عدد النترونات، والعدد الكتلي
تتكون النوى من نوعين من الجسيمات: النترونات والبروتونات. النترون عديم الشحنة، بينما يحمل البروتون شحنة كهربائية electric charge موجبة تعادل بالقيمة المطلقة الشحنة الكهربائية السالبة التي يحملها الإلكترون، ![]() ، عدد البروتونات في النواة هو العدد الذري
، عدد البروتونات في النواة هو العدد الذري ![]() ، بحيث تكون الذرة معتدلة كهربائياً إجمالاً.
، بحيث تكون الذرة معتدلة كهربائياً إجمالاً.
العدد الكتلي ![]() هو العدد الإجمالي للبروتونات والنترونات في النواة. بما أن للبروتون وللنترون الكتلة نفسها تقريباً، فإن كتلة الذرة تتناسب بدرجة عالية من الدقة مع العدد الكتلي. أما عدد النترونات في النواة، فهو الفرق بين العدد الإجمالي للبروتونات والنترونات
هو العدد الإجمالي للبروتونات والنترونات في النواة. بما أن للبروتون وللنترون الكتلة نفسها تقريباً، فإن كتلة الذرة تتناسب بدرجة عالية من الدقة مع العدد الكتلي. أما عدد النترونات في النواة، فهو الفرق بين العدد الإجمالي للبروتونات والنترونات ![]() وعدد البروتونات
وعدد البروتونات ![]() ، أي:
، أي:
![]()
- الجدول الدوري للعناصر
يحدد العدد الذري ![]() العنصر الكيميائي chemical element، ونعرف اليوم أكثر من
العنصر الكيميائي chemical element، ونعرف اليوم أكثر من ![]() عناصر كيميائية توافق نوى تضم من
عناصر كيميائية توافق نوى تضم من ![]() إلى
إلى ![]() بروتونات، وتشكل الجدول الدوري للعناصر.
بروتونات، وتشكل الجدول الدوري للعناصر.
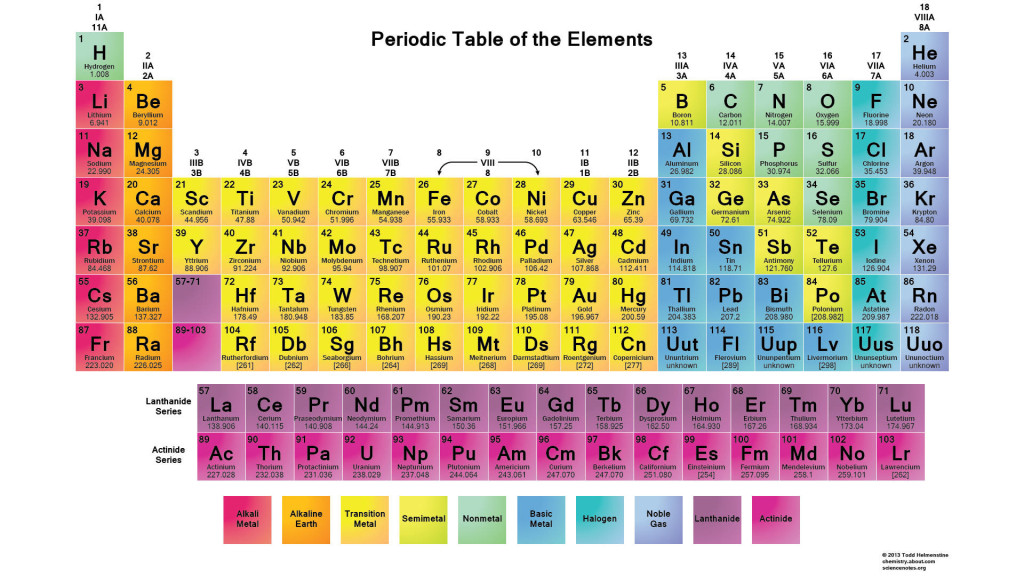
يرتب الجدول الدوري العناصر وفق خواصها الكيميائية بحيث تملك العناصر في ذات العمود من الجدول الدوري خواص كيميائية متشابهة.
تنتمي العناصر كالسيوم (Ca)، شترونتسيوم (Sr)، باريوم (Ba)، وراديوم (Ra) على سبيل المثال إلى ذات العمود في الجدول الدوري ولها خواص كيميائية متشابهة. الكالسيوم عنصر أساسي في تكوين العظام، وبالتالي تستهدف العناصر الأخرى العظم لأن الجسم سيعاملها بنفس الطريقة التي يتعامل بها مع الكالسيوم. هذا هام بالنسبة للتعرض الإشعاعي فهو يحدد مكان تأثير الإشعاع على الشخص المتعرض لنكليدات مشعة كالراديوم.
كما ذكر سابقاً يحدد العدد الذري ![]() العنصر الكيميائي، ونعرف الآن أكثر من
العنصر الكيميائي، ونعرف الآن أكثر من ![]() عناصر كيميائية. ولكن يمكن لنوى العنصر الواحد أن تمتلك أعداداً مختلفة من النترونات، وبالتالي أعداداً كتلية متباينة، ونعرف الآن أكثر من
عناصر كيميائية. ولكن يمكن لنوى العنصر الواحد أن تمتلك أعداداً مختلفة من النترونات، وبالتالي أعداداً كتلية متباينة، ونعرف الآن أكثر من ![]() نوع من النوى يدعى أي منها بالنكليد nuclide. تشير تسمية العنصر إلى التصنيف characterisation بناء على العدد الذري، أما تسمية النكليد فتشير إلى التصنيف بناء على العدد الذري وعدد النترونات. يرمز للنكليد عادة بالرمز الكيميائي للعنصر، ويشير إلى
نوع من النوى يدعى أي منها بالنكليد nuclide. تشير تسمية العنصر إلى التصنيف characterisation بناء على العدد الذري، أما تسمية النكليد فتشير إلى التصنيف بناء على العدد الذري وعدد النترونات. يرمز للنكليد عادة بالرمز الكيميائي للعنصر، ويشير إلى ![]() ، مسبوقاً بالعدد الكتلي كرمز علوي مثل
، مسبوقاً بالعدد الكتلي كرمز علوي مثل ![]() ،
، ![]() ، أو متلياً بالعدد الكتلي مثل
، أو متلياً بالعدد الكتلي مثل ![]() ،
، ![]() .
.
تعرف النكليدات التي تضم العدد نفسه من البروتونات، وبالتالي تنتمي إلى العنصر الكيميائي نفسه، ولكن أعداد مختلفة من النترونات بالنظائر.
- العدد الكتلي الوسطي
عندما يكون للعنصر الكيميائي الواحد عدة نظائر مستقرة، فإن الجدول الدوري للعناصر، يعطي العدد الكتلي الوسطي لهذه النظائر، والذي يتم حسابه باستخدام الأعداد الكتلية للنظائر المستقرة والوفرة النسبية لكل منها. الوفرة النسبية relative abundance للنظير هي النسبة المئوية لهذا النظير في العنصر الطبيعي natural element. للكلور على سبيل المثال نظيرين مستقرين: Cl-35 ويتوفر بنسبة حوالي 75% و Cl-37 بنسبة حوالي 25%. لذا فالعدد الكتلي الوسطي للكلور هو:
![]()
المرجع: محاضرات الدكتور سامي حداد في الفيزياء النووية– جامعة دمشق
تحرير: سامر عبد الرزاق بكر
شكرا
كيف نعرف نوع التفكك للانويه