حساب كمون التأيين الأول لعنصر اللورانسيوم يعيد الجدل حول طريقة توزيع العناصر ضمن الجدول الدوري
اللورانسيوم
عنصر مشع
رمزه Lr
عدده الذري 103
عمر النصف حوالي 27 ثانية
اكتشف عام 1961، وسمي لورانسيوم تكريماً للفيزيائي إرنست لورانس مخترع المسرع.
كمون التأيين الأول: هو كمية الطاقة المطلوبة لتأيين الذرة بطرد إلكترون واحد منها (إلكترون من المدار الذري الأبعد).
كيف تتم عملية الترتيب ضمن الجدول الدوري؟
إن القاعدة الأساسية في ترتيب الجدول الدوري هي زمن التأيين الأول لكل عنصر.
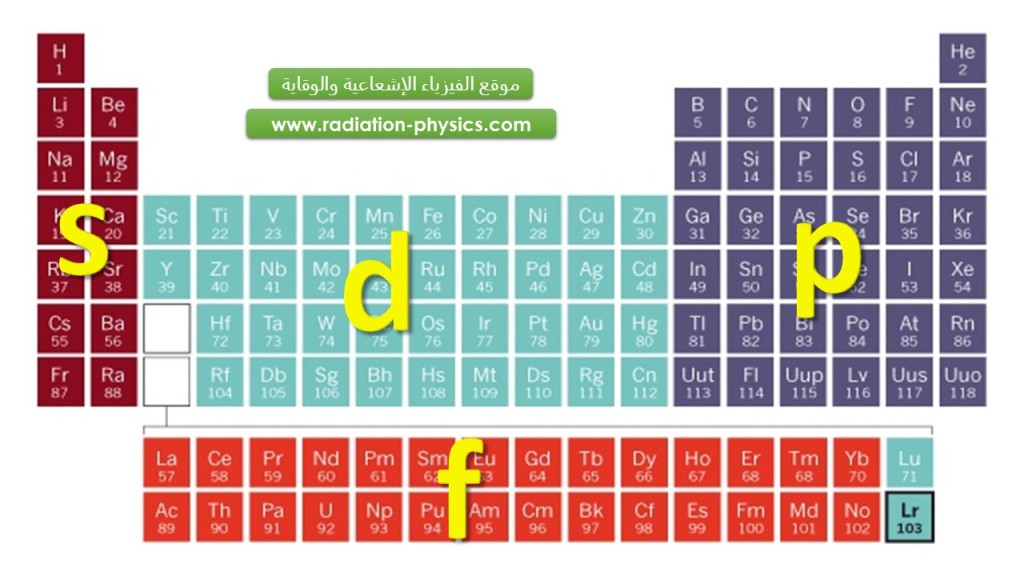
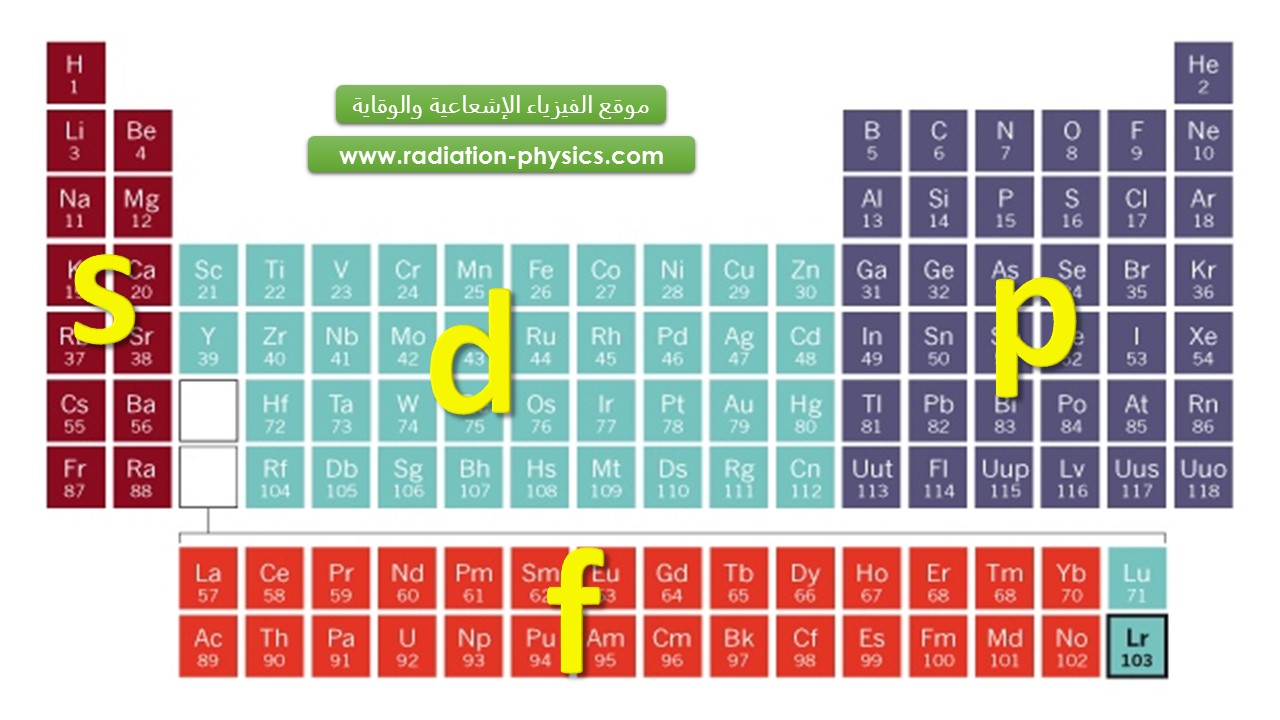
ويقسم الجدول الدوري لأربعة كتل S و P و D و F، بحسب المدارات الإلكترونية للعناصر. والمدارات هي مناطق غامضة يكون وجود الإلكترون فيها الأكثر احتمالاً حول النواة الذرية.
إن سهولة تخلص أو إضافة إلكترون للمدار الأخير تحدد الصفة الكيميائية للعنصر ولذلك تسلك جميع عناصر العمود نفس السلوك الكيميائي.
ترون ضمن الجدول الدوري العناصر الملونة في أسفله وهي لانثانيدات وأكتينيدات (سميت نسبة لاسم أول عنصر في الصف لانثيانيد وأكتينيد). كما أن ارتفاع كل عنصر في الجدول يعبر عن كمون التأيين الأول له.
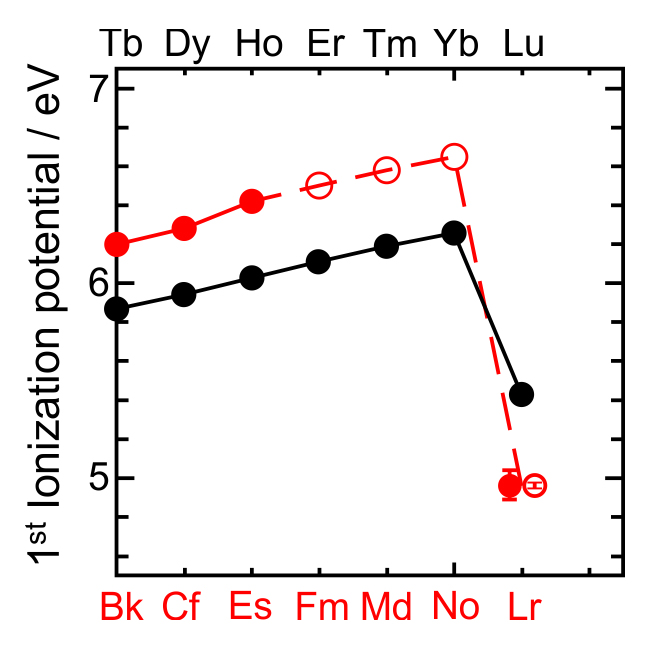
والنتيجة التي تم الحصول عليها لعنصر اللورانسيوم ممثلة باللون الأحمر. من الواضح أن طاقة ارتباط إلكترون التكافؤ في عنصر اللورانسيوم هي الأضعف مقارنة مع طاقات الارتباط للانثانيدات والأكتينيدات.
نجح مؤخراً فريق من الباحثين من مختلف أنحاء العالم بحساب كمون التأيين الأول لعنصر اللورانسيوم. ووصف الباحثون في ورقتهم العلمية المنشورة في مجلة ناتشورال Natural طريقة عملهم واعتقادهم لمكان العنصر في الجدول الدوري بحسب نتائج تجاربهم.
إن عنصر اللورانسيوم غير موجود في الطبيعة، وعملية الحصول عليه صعبة للغاية لا سيّما أنه يضمحل بعد بضع ثوان. في هذا العمل استخدم الباحثون تقنية معروفة لصناعة العنصر ثم ابتدعوا طريقة جديدة لحساب كمون التأيين الأول له.
ولحساب ذلك بالنسبة للورانسيوم صنع الباحثون بعض العينات وذلك بقذف ذرات البورون على قطعة من الكاليفورنيوم فنتجت بضع ذرات من نظير اللورانسيوم، وتم التقاط أولئك الذرات باستخدام الكادميوم المغشى باليود والموضع على قطعة معدنية مسخنة للدرجة 2700 كلفن (درجة حرارة كافية لطرد إلكترونات مدارية من بعض الذرات)، وبعد ذلك تم جمع الذرات المؤينة وحساب الطاقة المؤدية لذلك التأين.

وبهذه الطريقة وُجد أن الذرات تحتاج إلى 4.96 إلكترون فولط فقط لتتأين وهذه طاقة منخفضة وغير متوقعة على الإطلاق. تدل الطاقة المنخفضة على ضعف ارتباط الإلكترون الأخير وتحرره بسهولة، وهذه الصفة مشابهة للعناصر الموجودة في أقصى يسار الجدول (مثل الصوديوم والبوتاسيوم) أي أن وضع العنصر في المكان المشار إليه في الجدول الدوري قد لا يكون صحيحاً.
إن اللورانسيوم في هذه المرة يبدو كأن لديه شكل الدمبل (انظر الشكل المجاور).
 أي أنه ينتمي إلى مجموعتين فله صفات من أول مجموعة ومن الثانية فكيف سيكون تصنيفه في الجدول الدوري وهنا يكمن السؤال المحوري. يقترح بعض الباحثون ضم اللورانسيوم للكتلة D تحت عنصري السكانديوم والإتريوم، ومنهم من يقول يجب وضعه كملحق للكتلة F مع اللوتيتيوم.
أي أنه ينتمي إلى مجموعتين فله صفات من أول مجموعة ومن الثانية فكيف سيكون تصنيفه في الجدول الدوري وهنا يكمن السؤال المحوري. يقترح بعض الباحثون ضم اللورانسيوم للكتلة D تحت عنصري السكانديوم والإتريوم، ومنهم من يقول يجب وضعه كملحق للكتلة F مع اللوتيتيوم.
إن هذه النتائج الجديدة خلقت رؤى متضاربة، فأين يجب وضع العنصر ضمن الجدول؟!
ترجمة وإعداد: سامر عبد الرزاق بكر
المصادر:
https://goo.gl/WhDNij
https://goo.gl/82baoc